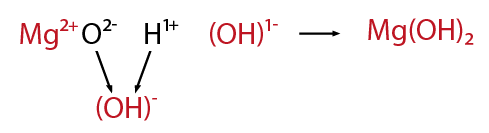
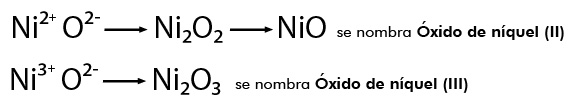
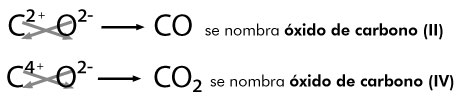
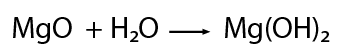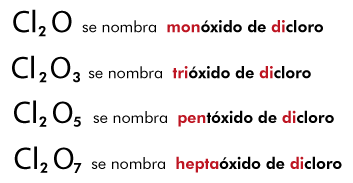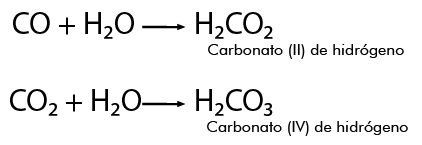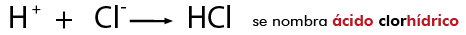Se establece entre átomos de elementos metálicos y no metálicos . Puede entenderse como consecuencia de la cesión permanente de electrones entre átomos y la consiguiente atracción electrostática derivada de la formación de iones.

Propiedades
- Tienden a formar sólidos cristalinos con temperaturas muy altas
- Son sólidos estables de estructura cristalina en el sistema cúbico, como consecuencia de las atracciones electrostáticas entre los iones de cargas contrarias.
- Los cristales iónicos son frágiles y pueden experimentar fracturas a lo largo de determinados planos del cristal.
- Son solubles en agua y otros solventes polares, siendo pequeña su solubilidad en los disolventes orgánicos.
- Altos puntos de fusión (entre 300°C y 1000°C) y ebullición.
Sin embargo existen excepciones como el CaF2 el cual presenta un elevado punto de fusión pero es insoluble en agua.
Los compuestos iónicos también presentan una baja conductividad eléctrica en el estado sólido pero se hacen buenos conductores de la electricidad cuando se funden o cuando se disuelven en disolventes polares como el agua.
- Una vez fundidos o en solución acuosa, conducen la electricidad, pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
- Los sólidos iónicos presentan estructuras con bajos números de coordinación, a diferencia de los sólidos metálicos, lo que explica su menor densidad.
Estructura
La fórmula de los compuestos iónicos, indican la relación que existe entre los iones que forman estos compuestos. Las sustancias iónicas, forman cristales de diversas formas geométricas, en lo que las partículas fundamentales son iones, que se mantienen unidos por fuerzas electrostáticas ejercidas en todas las direcciones del espacio, desde cada ion en particular, a continuación se muestra distintos tipos de estructuras iónicas.
| Tipo de estructura | Coordinación | Tipo de cristalización | Ejemplos |
|---|---|---|---|
| Cloruro de sodio (NaCl) | Catión: 6 | ||
| Cloruro de cesio (CsCl) | Catión: 8 | CsBr CsI | |
| Blenda (Sulfuro de zinc, ZnS) | Catión: 4 | ||
| Fluorita (Sulfuro de calcio, CaF2) | Catión: 8 | ||
| Rutilo (Óxido de titanio, TiO2) | Catión: 6 | MnO2 IrO2 |
Las consideraciones anteriores en relación con las estructuras de las redes cristalinas iónicas permiten comprender que en los sólidos iónicos existe un empaquetamiento de iones lo mas compacto posible, en dependencia de las cargas y de los radios de los iones.
En este empaquetamiento las fuerzas que mantienen unidos a los iones son fuerzas de atracción entre cargas eléctricas las cuales no se producen en una dirección determinada, sino en todas las direcciones del espacio a partir de cada ion. Todo esto permite explicar las propiedades características de los sólidos que presentan enlace iónico.
La estructura que se describirá es el modelo que describe a un gran número de sólidos iónicos.
¿Porque los compuestos iónicos conducen electricidad en el agua ?
NaCl, la sal, es uno de los compuestos iónicos más comunes. Cuando está en un estado sólido, es incapaz de conducir una corriente eléctrica. Solo puede conducirla cuando está disuelto en agua o en algún otro líquido. Para entender por qué pasa esto, primero es necesario entender la composición de los compuestos iónicos.
¿En que consiste la conductividad?
La conductividad se refiere generalmente a una propiedad eléctrica,pero puede también referirse a la transferencia térmica o acústica. Determinar la conductividad es complejo; decir que los materiales más densos son más conductores es demasiado simplista, ya que al aumentar la densidad puede acortar la distancia entre los átomos de transporte de energía por un lado, y aumentar la amortiguación por el otro.

En el vídeo que se muestra a continuación se da una clara explicación de que es un enlace químico , como se compone , actúa y se saca el enlace ionico .
¿Que son los sólidos cristalinos ?
Los SOLIDOS CRISTALINOS es cuando los átomos, iones o moléculas que lo constituyen se empaquetan siguiendo posiciones espaciales predeterminadas formando cristales.

Un SÓLIDO CRISTALINO es aquel que tiene una estructura periodica y ordenada , que se expande en las tres direcciones del espacio , por lo que presentan una forma invariante salvo por la acción de fuerzas externas .

El vídeo de Sólidos Cristalinos habla sobre su composición y su uso , también se hace mensión de que son los sólidos amorfos , y los sistemas cristalinos .
¿Que tiene que ver un solido cristalino con el enlace iónico?
¿Que es la solvatación?
Es el proceso de atraccion y asociasion de moleculas de un disolvente con moleculas o iones de soluto.Al disolverse los iones es un solvente,se dispersan y son rodeados por moleculas de solvente.A mayor tamaño del ion, mas moléculas de solvente son capaces de rodearlo, y mas solvatado se encuentra el ion.
La solvatación involucra a diferentes tipos de interacciones moleculares: puente de hidrógeno, ion-dipolo, atracción dipolo-dipolo o fuerzas de London. Los tres primeros pueden estar presentes sólo en solventes polares. Las interacciones ion-ion sólo pueden suceder en solventes iónicos (por ejemplo, en fase fundida). Los procesos de solvatación sólo estarán termodinámicamente favorecidos si la energía libre de Gibbs de formación de la solución es menor que la suma de la energía libre de Gibbs de formación del solvente y el soluto por separado.
La conductividad de una solución depende de la solvatación de sus iones.